1.76乘以2目录
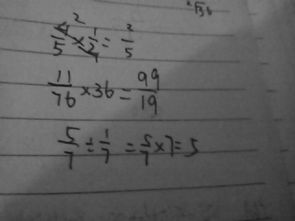
第一次样品5克与200克盐酸生成二氧化碳1.76克
第二次样品5x2=10克与200克盐酸,生成二氧化碳1.76x2=3.52克
那,第三次样品5x3=15克与200克盐酸,应该生成二氧化碳1.76x3=5.28克
但实际上只有4.4克,说明15克样品与盐酸没有完全反应
说明要么样品不足,要么盐酸不足,题目中样品是足量多的,那样说是盐酸不足。
但是第一次和第二次是完全反应,
第三次200克盐酸已经不能与15克样品完全反应,矿石有剩余
第四次,盐酸一样那么多。
样品再多,最多也只能生成4.4克气体,所以M的值为4.4克
计算样品含量,按完全反应的情况,数据确切才好计算。
CaCO3 2HCl=CaCl2 H2O CO2
100.............................................44
x.................................................1.76
100/x=77/1.76
x=4,含量4/5=80
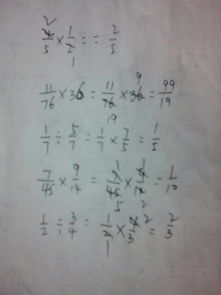
【1】答案:混合后OH-离子浓度为:A1.76乘以10的负5次方
【2】计算:[OH-]=KbX(2mol/2)/(2mol/2)=Kb=1.76X10^-5

129/2=64余1
64/2=32余0
32/2=16余0
16/2=8余0
8/2=4余0
4/2=2余0
2/2=1余0
1/2=0余1
129=(10000001)2
0.22*2=0.44整数为0
0.44*2=0.88整数为0
0.88*2=1.76整数为1
0.76*2=1.52整数为1
0.52*2=1.04整数为1
0.22≈(0.00111)2
129.22≈(10000001.00111)2
